Technology
HUNS001:自家骨髄MSC製品
骨髄MSCは、1998年に神経系細胞へ分化することが報告されて依頼、中枢神経系疾患への治療応用の試みが20年以上続けられている、見方によっては「枯れた技術」です。一方で再生医療という最先端技術のショーケースの中で存在感を失わないということは、骨髄MSCが高い安全性と有効性のポテンシャルを有している証です。しかし、それを臨床で発揮するにはいくつかの選択肢から最適解を見つける必要があります。すなわち、どのような(自家、他家)細胞を、いつ(急性期、慢性期)、どのように(経静脈的、脳内)、投与するかということです。
私たちは北海道大学脳神経外科において、2001年から脳梗塞に対する骨髄MSC治療の基礎研究を継続してきました。結果、私たちは臨床応用に、自家MSCを、亜急性期に、脳内に直接投与することを選択し、HUNS001の第1相治験プロトコールとして結実しました。そして、第1相治験で浮上した産業上の課題を解決すべく、第2相治験では慢性期脳梗塞へシフトします。さらに第2相治験では、新規性の高い細胞培養・輸送・投与方法を採用して有効性と安全性を高めるとともに、トータルパッケージとして他社の参入障壁となる知財戦略をとっています。
また、HUNS001の独自の供給体制も強みの一つです。第2相治験では、承認以降の全国展開を視野に、複数の大学病院やナショナルセンター等(以下、大学病院)と協力した多施設共同研究とする予定です。そして承認後は、大学病院だけではなく、CPCを持たない地域基幹病院や包括的脳卒中センター(以下、関連病院)でも製品の投与が可能な供給体制を整えます。
この供給体制の重要な点は、CPC(ローカルCPC、図のⒸ)をもつ大学病院と、そこから距離が離れていない複数の関連病院が一つのグループを組むことです(図の破線円内)。まず、慢性期患者さんが関連病院に短期入院し骨髄採取などを行います。骨髄はセントラルCPC(培養委託先企業、図のⒷ)に輸送され、細胞培養が開始されます。3-4週間後、細胞培養が終了したら、セントラルCPCからローカルCPCに培養細胞を輸送します。ローカルCPCでは細胞を洗浄し容器にパッキングして、製品として近隣の関連病院(または自院の手術室)に出荷します。製品を受け取った関連病院では、同日に患者さんに定位的脳内細胞移植術を行うこととなります。この体制構築によって、上市後の問題となる実施施設数の伸び悩みを解決できます。
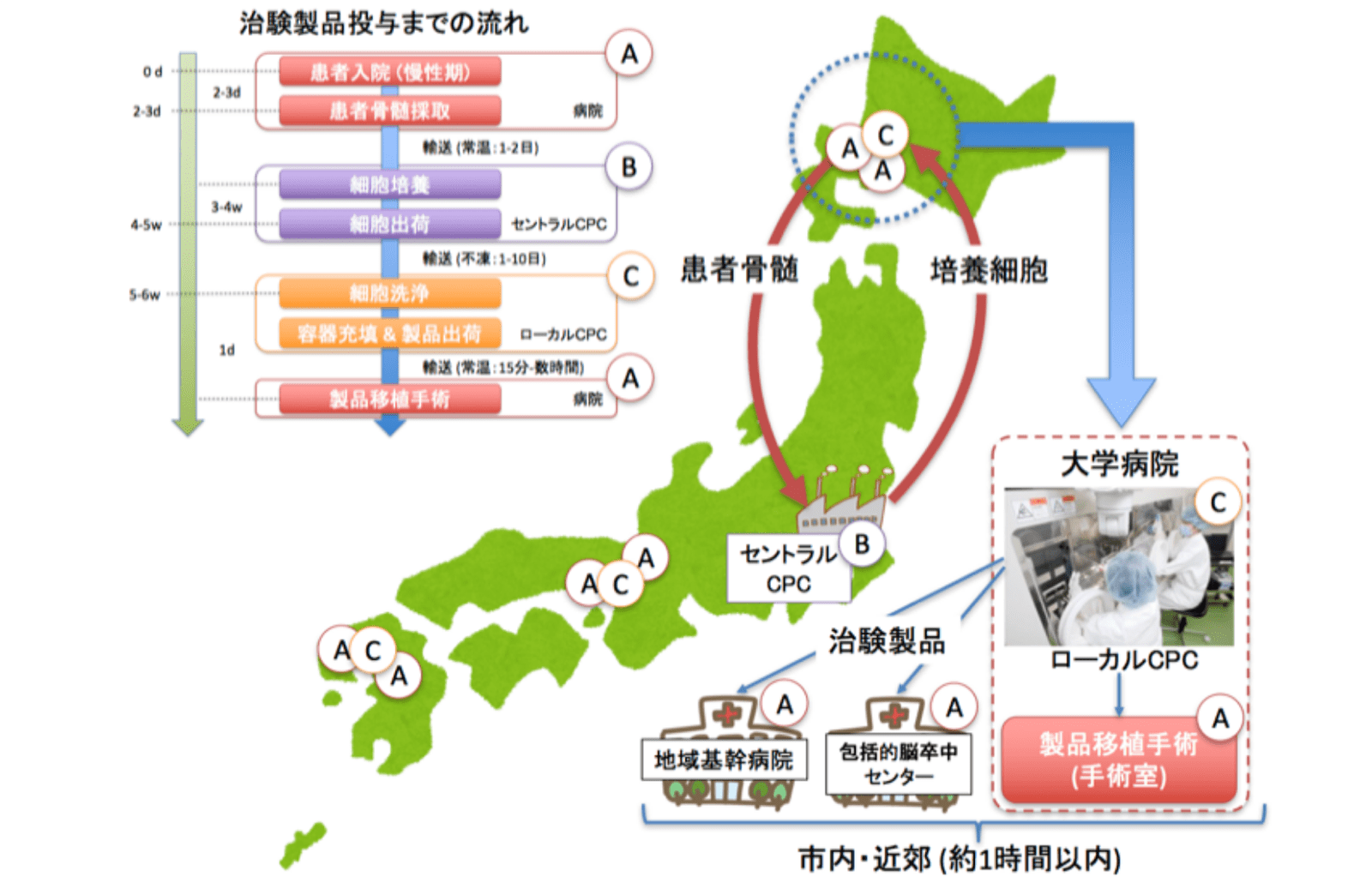
HUNS001の有効性、安全性、
新規性の高い細胞培養・輸送・投与方法
①高い有効性:多様な作用機序
脳梗塞など中枢神経系疾患に対する骨髄MSCの効果には、以下の3つの作用機序が考えられています。
1) 移植されたMSCが脳損傷部周辺に遊走し、同部位でサイトカインや栄養因子を分泌し、神経保護効果、軸索伸長効果、内在性神経幹細胞賦活化、免疫調整効果などを発揮する(nursing effect):
骨髄MSCは骨髄間質細胞(bone marrow stromal cells; BMSC)の別名を持つように、生理的には骨髄腔内で造血幹細胞のniche(幹細胞がその性質を維持するために必要な微小環境)を形成しますが、この性質によりnursing effect の一つである患者脳内の神経幹細胞を賦活化する作用を説明できます。
2) 移植されたMSCが脳損傷部周辺に遊走し、同部位で神経系細胞や血管内皮細胞、血管周細胞(ペリサイト)などに分化する(transdifferentiation):
骨髄MSCの起源は神経上皮や神経堤細胞由来とされ、中胚葉由来である脂肪組織由来MSCなどとは性質が異なります。最近の研究では、骨髄MSCと脳内のペリサイトや脳軟膜細胞との類似性が取りざたされており、transdifferentiation を理解する助けとなります。
3) 超急性期に全身投与されたMSCは、脾臓や胸腺などの免疫組織に集積して強い免疫調整効果を示し、遠隔的に脳損傷の増悪を抑制する(immunomodulation, remote effect):
骨髄MSC由来製品であるテムセル(JCRファーマ)は急性移植片対宿主病(GVHD)を対象疾患としていますが、このことは中枢神経疾患を対象とする骨髄MSC やその派生製品の有する immunomodulation 効果を直接説明できます。
これらの多様な作用機序は、骨髄MSCの組成や性質がheterogeneousであることに由来しています。またこれらの作用機序も、どのような(自家、他家)細胞を、いつ(急性期、慢性期)、どのように(経静脈的、脳内)投与するか、ということで大きく変化します。HUNS001では脳損傷部周辺に直接投与するため、その作用機序としては 1) nursing effect (軸索伸長効果や内在性神経幹細胞賦活化など) の占める割合が高いと考えます。第1相治験にて示された、損傷された錐体路(大脳皮質運動野から下行する運動性神経軸索経路)や側脳室下帯(内在性神経幹細胞が局在する部位)へHUNS001が遊走するMRI所見は、強い示唆を与えています。さらに、HUNS001は自家細胞由来であるため、脳内での長期生着が期待できます。このため、2) transdifferentiation も作用機序として重要であると考えられます。第1相治験では、MRIによりHUNS001移植2年後の脳損傷部周辺での生着が示され、さらに移植後6ヶ月〜1年という時期にも神経症状回復が示されており、transdifferentiation による作用が示唆されます。
②高い安全性:自家細胞由来で、ソーティングや遺伝子操作を行っていない
HUNS001は患者自身の骨髄を原料とし、細胞培養時にソーティングや遺伝子操作を行っておらず、有害な免疫反応や腫瘍原性は生じません。培養添加物にはヒト血小板溶解物を使用しており、潜在的なzoonosisのリスクを回避できます。またHUNS001は免疫抑制剤を使用せずに長期間の組織内生着が見込め、高齢者の多い脳梗塞患者では感染症対策の点でも有利です。
一方でHUNS001では脳内直接投与を行うため、経静脈的投与を行う製品と比べ潜在的なリスクを有します。しかし、第1相治験では現時点で穿刺手技に伴う頭蓋内出血やてんかんなどの有害事象を認めていません。亜急性期の脳損傷部は新生血管が発達するため、健常部に比べ穿刺時の出血リスクが高まりますが、HUNS001は高い脳内遊走能を有するため脳損傷部から十分なマージンを取り安全な部位に移植できます。また、HUNS001ではレクセル定位脳手術システムを用いて高精度な細胞移植を行っていることも、安全性に貢献しています。さらに第1相治験では急性〜亜急性期の患者さんが対象ですが、第2相治験では全身及び脳損傷部の状態が安定した慢性期の患者さんを対象とするため、より安全な治療が可能です。
③新規性の高い細胞培養・輸送・投与方法
1) 血小板溶解物(PL)と新規培養添加物を用いた新規培養法
第1相治験ではアニマルフリーの細胞培養添加物として、FBSの代わりにヒト(他家)PLをもちいています。第2相治験では全身状態の安定した慢性期の患者さんが対象なので、患者さんから血小板成分採血を行い自家PLにより培養する予定です。さらに新規培養添加物を併用して、安全で高効率な細胞培養を行います(特許出願準備中)。
2) 高い細胞生存率を保つ新規細胞輸送法
細胞製品の輸送で問題となるのは、凍結・解凍による細胞生存率低下です。HUNS001の第1相治験では温度管理をしながら製品を輸送するシミュレーションを行いましたが、第2相治験では長距離輸送が必要なため、高い細胞生存率を保つ革新的な細胞輸送法を開発しています(特許出願準備中)。
3) 細胞移植前の脳MRIによる回復可能性の評価法
第1相治験では、細胞移植前の脳の損傷程度により、HUNS001の治療効果に影響が見られました。第2相治験では移植前の脳MRIにより損傷を評価し、回復可能性の高い患者だけを被験者に組み入れます(特許出願準備中)。
4) 脳内移植の安全性を高める新規移植針(特願2019-102123)
HUNS001は脳内へ直接投与するため潜在的なリスクを有します。私たちは、より安全な治療とするために移植針を新たに開発しました。
5) 脳内移植部位最適化のための新規ソフトウェア
第2相治験を多施設共同研究とする上で問題なのは投与部位を決定する方法です。これは安全性・有効性に大きな影響を与えるため、第1相の結果をもとに客観的に投与部位を決定するソフトウェアを開発中です(特許出願準備中)。
既存技術、他社技術との比較
| 経静脈投与 | 脳内直接投与 | |
|---|---|---|
| 自家MSC | STR01(ニプロ/札幌医大) | HUNS001(RAINBOW/北大) |
| 他家MSC | MultiStem(ヘリオス/アサシス) CL2020(LSII/東北大学) JTR-161(帝人/JCRファーマ) | SB623(サンバイオ) |
| On-set | days | weeks | months | years |
|---|---|---|---|---|
| 自家MSC | HUNS001 第1相 STR01 | HUNS001 第2相 | ||
| 他家MSC | MultiStem JTR-161 | CL2020 | SB623 |
開発パイプライン
脳梗塞
第Ⅰ相試験中
2023年より
第Ⅱ相(慢性期)を予定
脳出血
第Ⅰ相試験に向けた
基礎研究進行中
2022年より
第Ⅰ相(慢性期)を予定
脊髄損傷
第Ⅰ相試験に向けた
基礎研究進行中
第Ⅰ相試験に向けた
基礎研究進行中
脳梗塞以外の中枢神経疾患、特に脳出血と脊髄損傷を対象とした再生医療等製品について、北大脳神経外科(当社研究開発担当取締役:川堀真人助教のグループ)にて開発が進められています。脳出血では、脳梗塞とは疾患の性質が異なることを考慮し製品開発を進めていますし、また脊髄損傷では、疾患の性質に加え脊髄特有の組織学的問題を考慮した投与法について研究を行っています。これらの研究は、今後当社と北大脳神経外科との共同研究として実施され、ここで発生する知財に関しても、当社が独占的に使用する権利を取得する予定です。